| انسولین هورمونی است که از سلولهای بتای جزایر لانگرهانس غده لوزوالمعده ترشح میشود. ساختمان آن از دو زنجیره پلیپپتیدی A و B ساخته شده که بوسیله پیوندهای دیسولفور به یکدیگر متصل شدهاند. نقش این هورمون در تنظیم قند خون (گلوکز) شناخته شده است. ژن انسولین در روی بازوی کوتاه کروموزوم شماره 11 قرار گرفته است. |
دید کلی
متابولیزم
کربوهیدراتها ،
لیپیدها و
پروتئینها تحت کنترل و تنظیم خیلی دقیق بوده که این اعمال بوسیله هورمونهای مترشحه از لوزوالمعده صورت میگیرند. لوزوالمعده از دو نوع غده مترشحه کاملا متمایز تشکیل یافته است. یکی غدهای برون ریز با ساختمان خوشهای که ترشحات خود را برای کمک به هضم مواد غذایی در
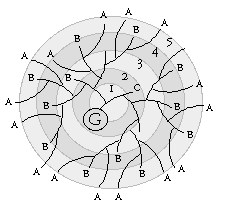
دوازدهه میریزد و دیگری غدهای درون ریز که از جزایر موسوم به جزایر لانگرهانس تشکیل یافته است. جزایر لانگرهانس که در تمام بافت لوزوالمعده پراکنده هستند، مجموعههایی تخم مرغی شکل متشکل از چهار نوع سلول مترشحه (A ، B ، D و F) با وظایف متفاوت هستند.
|
|
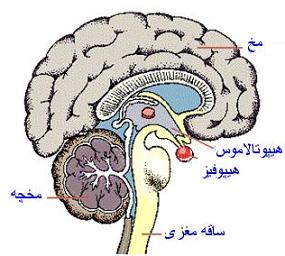
محل ساخت انسولین در پانکراس |
ساخت انسولین در سلولهای B جزایر لانگرهانس صورت میگیرد. در این حالت انسولین به صورت پیش هورمون است و پس از تغییر و تحولاتی که در ساختار آن ایجاد میشود به انسولین تبدیل میشود. ترشح انسولین به جریان خون پیچیده بوده، بطوری که
یون کلسیم در آن نقش داشته و در نتیجه بوسیله عمل
اگزوسیتوز محتویات دانههای ترشحی به محیط خارج سلولی ترشح میشود. گلوکز محرک ترشح انسولین است. به این صورت که گیرندههای اختصاصی گلوکز بر روی سلولهای بتا ، تحریک ترشح انسولین را در زمانی که
گلوکز خون زیاد میشود، انجام میدهند.
تاریخچه
برای اولین بار در سال 1921 بوجود انسولین در عصاره جدا شده از جزایر لانگرهانس پی برده شد و به سرعت اثرات آن در کاهش قند خون شناخته شد و پس از مدت کوتاهی انسولین گاو و خوک در درمان
بیماری قند در انسان مورد استفاده قرار گرفت. انسولین نخستین پروتئینی بود که: خواص هورمونی آن شناخته شد، به صورت کاملا خالص و متبلور تهیه شد، نوع و ردیف
اسیدهای آمینه آن تعیین گردید و از راه مصنوعی تهیه شد. پروتئین پیش ساز آن شناخته شد و بالاخره اولین پروتئینی بود که به کمک
روشهای تولید DNA نوترکیب (Recombinant DNA) برای مصارف تجاری تهیه شد.
ساختمان شیمیایی انسولین
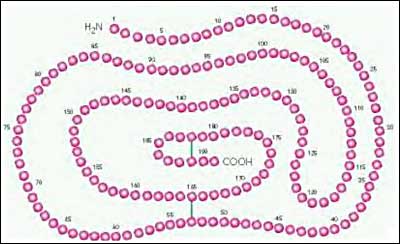
انسولین پلیپپتیدی است که از دو زنجیره پپتیدی A و B تشکیل یافته است. تعداد اسیدهای آمینه در زنجیرهها که در زنجیره A برابر 21 و در زنجیره B برابر 30 میباشد، در انسولینهای جدا شده از اغلب گونههای حیوانی ثابت است. این دو زنجیره به کمک دو پل دیسولفور ، یکی بین اسیدهای آمینه شماره 7 از دو زنجیره و دیگری میان اسیدهای آمینه شماره 20 از زنجیره A و شماره 19 از زنجیره B با یکدیگر اتصال دارند. علاوه بر این ، ریشههای اسید آمینه ردیف 6 و 11 در داخل زنجیره A بوسیله پیوند دیسولفور به یکدیگر متصل هستند. مکان این پیوندها در گونههای مختلف ، ثابت است.
پژوهشگران با بررسی اثرات تغییرات شیمیایی هر یک از
اسیدهای آمینه در ردیفهای مختلف ساختمان انسولین موفق شدهاند، قسمتهایی از ساختمان انسولین را که برای بروز اثرات زیست شناختی آن ضروری هستند را تعیین کنند. انسولین در غلظتهای فیزیولوژیک به صورت یک مونومر ساده میباشد و در غلظتهای بالاتر ، انسولین پلیمریزه شده و ساختمان کمپلکس را به خود میگیرد و یونهای روی (Zn ) نقش بسیار مهمی را در ایجاد این کمپلکس بر عهده دارند.
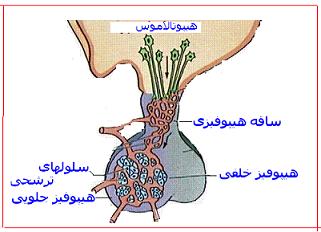
بیوسنتز انسولین
بیوسنتز انسولین و بسته بندی هورمون به صورت دانههای ترشح کننده با نظم معین در درون
سلولهای بتا جزایر لانگرهانس غده لوزوالمعده صورت میگیرد. ابتدا هورمون به صورت پری پرو انسولین توسط
ریبوزومهایی که بر روی
شبکه آندوپلاسمی خشن سلولها قرار گرفتهاند ساخته میشود. این پیش ساز که دارای 23 اسیدآمینه آب گریز بنام قطعه رهبر است به داخل شبکه آندوپلاسمی هدایت میشود. در داخل شبکه این قطعه جدا شده و پیش ساز به "پرو انسولین" تبدیل میشود. آرایش فضایی این مولکول به صورتی است که شرایط ایجاد پلهای دیسولفور را فراهم میسازد.
در ساختمان پروانسولین ، از جهت ریشه آمین اتنهایی ، ابتدا زنجیره B قرار گرفته که با یک رشته اسید آمینه به نام "پپتید C" متصل شده و انتهای دیگر پپتید C با زنجیره A پیوند یافته است. پروانسولین به داخل
دستگاه گلژی منتقل شده تا تحت تاثیر آنزیمهای پروتئولیز کننده، مولکولهای انسولین آزاد میشوند که پس از تجزیه دو زنجیره A و B پپتید C آزاد میشود. دو زنجیره A و B بوسیله پیوندهای دیسولفور به هم متصل میشوند و انسولین کامل را بهجود میآورند. ساختمان و شکل دانههای ترشح کننده انسولین در حین عبور از داخل
غشای پلاسمایی تکمیل میشود. این هورمون با یون روی ترکیب شده و هگزامرهایی را تشکیل میدهند. این دانهها تحت تاثیر تحریکات خاصی با غشای سلول درآمیخته و محتوای خود را به روش اگزوسیتوز به خارج میریزند.
سیستم تنظیم ترشح انسولین
اثر گلوکز
افزایش گلوکز خون ، مهمترین عامل فیزیولوژیک تنظیم کننده ترشح انسولین است. غلظت گلوکز خون در حالت ناشتا (80 - 100 میلی گرم درصد) آستانه غلظتی است که تجاوز از آن با تحریک ترشح انسولین همراه است. و بیشترین اثر محرک گلوکز زمانی حاصل میشود که غلظت آن در خون به حدود 500 - 300 میلیگرم درصد برسد.
اثر اسیدهای آمینه ، اسیدهای چرب و ترکیبات کتونی
غذاهای غنی از پروتئین ، ترشح انسولین را تحریک مینمایند و اسیدهای آمینه آرژینین ، لیزین و لوسین از محرکهای قوی ترشح انسولین هستند. اثر غلظتهای فیزیولوژیک
اسیدهای چرب و ترکیبات کتونی در تحریک ترشح انسولین بسیار ضعیف است.
اثر سایر هورمونها
تعداد زیادی از هورمونها در ترشح انسولین موثر هستند. پلیپپتید مهار کننده معدهای (GIP) ، غلظتهای زیاد
گاسترین ،
سکرتین و
گلوکاگن رودهایاز طریق افزایش غلظت AMP حلقوی داخل سلولی ، در تحریک ترشح انسولین شرکت دارند. اثر غلظتهای زیاد و طولانی
هورمون رشد ،
کورتیزول ،
لاکتوژن جفتی ،
استروژن و
پروستروژن نیز منجر به افزایش ترشح انسولین میگردد.
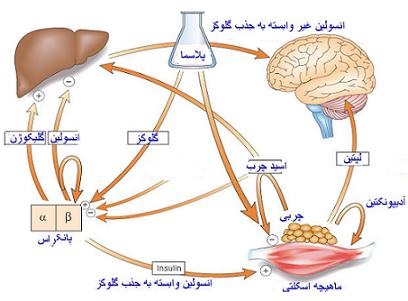
اثر انسولین در تبادلات غشاهای سلولی
سرعت واکنشهای فسفوریلاسیون گلوکز و
متابولیسم گلوکز در
سلولهای عضلانی و
بافت چربی با سرعت انتقال گلوکز به داخل سلول متناسب است. D - گلوکز و قندهای شبیه به آن برای عبور از غشا سلول نیاز به حامل دارند و در اغلب بافتها انسولین نقش تقویت کننده این سیستم حامل را بر عهده دارد. تحت تاثیر انسولین تعداد حاملها افزایش مییابد. علاوه بر گلوکز ، انسولین عمل انتقال اسیدهای آمینه ، یونهای
پتاسیم و
کلسیم ، نوکلئوتیدها و فسفات معدنی را از غشاهای سلولی تقویت میکند.
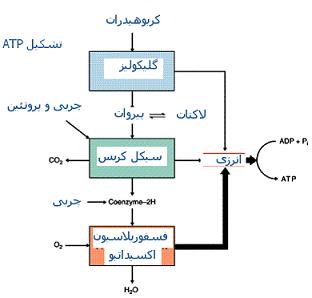
اثرات انسولین در متابولیسم گلوکز
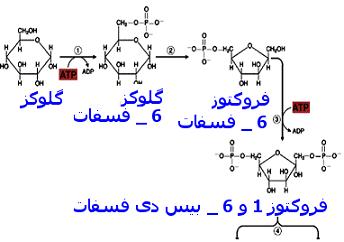
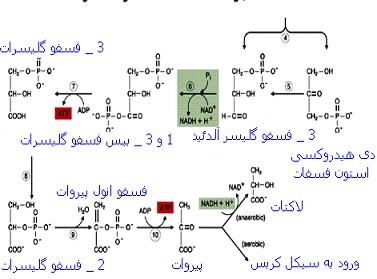
انسولین با افزایش کمی و همچنین افزایش فعالیت تعدادی از آنزیمهای کلیدی در
واکنشهای گلیکولیز کبدی مانند آنزیمهای
گلوکوکیناز و
پیروات کیناز ، مصرف گلوکز در مسیر گلیکولیز را افزایش داده و بطور غیرمستقیم از رها شدن گلوکز در پلاسمای خون جلوگیری میکند. از سوی دیگر ، انسولین با کاهش فعالیت
آنزیم گلوکز 6- فسفاتاز موجود در کبد از آزاد شدن گلوکز جلوگیری میکند. چون گلوکز 6- فسفات قادر به عبور از غشا سلول کبدی نیست، عمل انسولین منجر به نگهداری گلوکز در داخل
سلولهای کبدی میشود.
یکی دیگر از اثرات انسولین که منجر به کاهش غلظت گلوکز در پلاسما میگردد، اثراتی است دیررس که در نتیجه مهار کردن واکنشهای نوسازی گلوکز حاصل میگردد. مهمترین
آنزیم کلیدی در واکنشهای نوسازی گلوکز از مواد غیر قندی در کبد
آنزیم فسفوانول پیروات کربوکسی کیناز میباشد که واکنش تبدیل شدن
اگزالواستات به
فسفوانول پیروات را کاتالیز میکند. انسولین با ویژگی خاص ، اثر بازدارنده در رونویسی ژن این آنزیم داشته و از سنتز RNA پیامبر مربوط به آن ، جلوگیری میکند.
اثر انسولین در متابولیزم چربیها
در بافتهای کبدی و چربی ، انسولین دارای اثر بازدارنده قوی در واکنشهای لیپولیز (تجزیه چربیها) است که این اثر نیز خود بطور غیر مستقیم به اثرات آنابولیسمی میانجامد. اثر بازدارنده انسولین در واکنشهای لیپولیز از دو راه صورت میگیرد. در حالیکه هورمونهای محرک واکنشهای لیپولیز یعنی
گلوکاگن و
اپی نفرین عمل خود را از طریق افزایش غلظت AMP حلقوی به انجام میرسانند، انسولین با اثری مخالف موجب کاهش غلظت AMP حلقوی میگردد. انسولین با فعال ساختن یک آنزیم فسفاتاز ویژه ، از فعالیت
آنزیم لیپاز ، که در تجزیه چربیها نقش دارد جلوگیری مینماید. اثر بازدارنده انسولین در واکنشهای لیپولیز به کاهش غلظت
اسیدهای چرب آزاد در جریان خون و نهایتا به افزایش اثرات انسولین در متابولیسم گلوکز میانجامد.
اثر انسولین در متابولیسم پروتئینها
انسولین اصولا دارای اثر آنابولیسمی در
متابولیسم پروتئینها است به این معنی که واکنشهای سنتز پروتئینها را فعال ساخته و از تجزیه آنها جلوگیری میکند. انسولین جذب اسیدهای آمینه خنثی را توسط سلولهای عضلانی افزایش میدهد. اثر اصلی انسولین در افزایش سنتز پروتئینهای بدن (اسکلت ، عضله ، قلب و کبد) در طی مراحل واکنشهای بیوسنتز پروتئینها به ویژه در مرحله
ترجمه RNA پیامبر به پروتئین ، بروز مینماید. انسولین قادر است با تغییراتی که در بعضی
RNA های پیامبر (mRNA) ایجاد مینماید، در سنتز پروتئینهای خاص تاثیر بگذارد.
بیماریهای ناشی از بروز اختلال در ترشح انسولین
کمبود ترشح انسولین و همچنین پیدایش مقاومت در برابر عمل انسولین منجر به بیماری دیابت قندی میگردد. تقریبا 90درصد افراد بیمار ، مبتلا به دیابت قندی نوع II یعنی دیابت قندی غیر وابسته به انسولین هستند. این بیماران معمولا افراد چاقی بوده و غلظت انسولین در پلاسمای خون آنها زیاد است. که این افراد در پروتئینهای پذیرنده انسولین موجود در غشا ، دچار اشکال هستند.
نقش مهم انسولین در رشد و نمو اندامها در دوران جنینی را میتوان با بررسی نوزادان غیر طبیعی مبتلا به سندرم لپرشونیسم ارزیابی کرد. در این نوزادان ، وزن بدن کمتر از حد طبیعی ، رشد عضلات ناقص ، مقدار چربی زیر پوست کم و عمر نوزاد کوتاه است. این نوزادان در برابر انسولین مقاوم هستند با اینکه مقدار هورمون در خون زیاد است ولی به دلیل نداشتن پروتئین پذیرنده انسولین ، قادر به استفاده از آن نیستند.
برگرفته از دانشنامه رشد




 به نام خدا :
به نام خدا :